お客様の認証情報を現在確認中です。
投与に関する確認事項
調製準備と投与方法 動画
テッペーザ®の調製準備と投与方法についてご紹介します。
-
概要
-
ナレーション
テッペーザ®の調製準備と投与方法
再生時間 06:15
この動画では、テッペーザ®の調製準備と投与方法についてご紹介します。
テッペーザ®は、1バイアル中にテプロツムマブ(遺伝子組換え)として524mgを含有する凍結乾燥製剤で、用時溶解して用いる注射剤です。
テッペーザ®は個装箱に入れたまま冷蔵庫(2℃~8℃)で凍結を避けて保存してください。個装箱を開封した後は遮光して保存してください。
テッペーザ®は3週間間隔で、計8回投与します。
患者さんの体重に応じて投与量を算出します。初回は10mg/kgを投与し、投与2回目~8回目では20mg/kgを投与します。
投与前の準備として、患者さんの体重に応じた必要な数のテッペーザ®のバイアル、滅菌シリンジと注射針、日局注射用水、輸液バッグ(日局生理食塩液)、輸液投与セット、及び通常の輸液用品を用意します。
インラインフィルターの用意は任意です。テッペーザ®専用のチューブは特にありません。使用前に、必ずバイアルのラベルを読み有効期限が切れていないことを確認してください。
また、バイアル内に変色又は異物がないことを確認してください。変色又は異物が認められる場合は使用しないでください。
ここから無菌的に調製を行います。ゴム栓をアルコール綿で消毒し、自然に乾燥させます。テッペーザ®のバイアル1本につき日局注射用水10mLで溶解します。日局注射用水を凍結乾燥粉末に直接かけないようバイアルの内壁にそってゆっくり注入します。バイアルを回転させて静かに、内容物を完全に溶解します。振とうしないでください。
完全に溶解後の溶液は、11mL(最終濃度47.6mg/mL)になります。
次の操作に進む前に、バイアル内の溶解液が無色~わずかに褐色の澄明の液で、粒子状物質を含まないことを目視により確認します。変色又は粒子状物質が認められる場合は使用しないでください。
次に、溶解液を希釈します。投与量に応じて適切な輸液バッグ(日局生理食塩液)を選択します。投与量が1,800mg未満の場合は、100mLのバッグを使用してください。投与量が1,800mg以上の場合は、250mLのバッグを使用してください。
輸液バッグから予め注入する溶解液分の容量(患者の体重(kg)に基づいて計算した必要量)を滅菌シリンジ及び注射針を用いて抜き取ります。患者の体重(kg)に基づいて、あらかじめ計算した必要量をバイアル(溶解後の溶液)から抜き取り、同量の日局生理食塩液を抜き取った輸液バッグに溶解します。
輸液バッグを静かに上下に逆転させ、混和します。振とうしないでください。
使用後のバイアルと溶解後の溶液の未使用分は廃棄してください。
溶解後又は希釈後、直ちに使用できない場合、溶解後の溶液又は輸液バッグ内の希釈液は、遮光保存し、2~8℃で保存する場合は、調製開始から投与まで48時間以内、20~25℃で保存する場合は、調製開始から投与まで4時間以内に使用してください。すぐに投与しない場合は、必ず遮光してください。
投与前に冷蔵した場合は、希釈液を室温に戻してから使用してください。
ここからは投与についてご紹介します。
1回目及び2回目の注入は、希釈液を90分かけて点滴静注します。患者さんの状態を確認し、異常がなければ投与3回目以降の注入時間を60分まで短縮することができます。忍容性が良好でない場合は、その後の注入時間は90分以上とします。
ワンショット静注や、急速静注で投与しないでください。また、独立したラインにて投与するものとし、他の注射剤、輸液等と混合しないでください。
投与中は、施設のプロトコルに従ってInfusion reactionをモニタリングしてください。Infusion reactionが認められた場合は、投与を中止し、適切な処置を行ってください。Infusion reactionが認められた患者では、次回以降の投与前に、抗ヒスタミン薬や解熱薬又は副腎皮質ステロイドの前投薬を検討し、投与速度を遅くする等の処置を検討してください。
投与が完了したら、物品を廃棄します。
テッペーザ®の適正使用情報については、テッペーザ®医療関係者向け製品サイトをご参照ください。 製品に関するお問い合わせは、0120-790-549までお電話ください。
テッペーザ®の詳細については、最新の電子添文をご参照ください。
用法及び用量
6. 用法及び用量
通常、成人にはテプロツムマブ(遺伝子組換え)として初回は10mg/kgを、2回目以降は20mg/kgを7回、3週間間隔で計8回点滴静注する。
用法及び用量に関連する注意
7. 用法及び用量に関連する注意
日局注射用水で溶解し、日局生理食塩液で希釈した後に投与すること。投与時間は90分とすること。
患者の忍容性が十分に確認された場合、3回目以降の投与時間は60分まで短縮することができる。
忍容性が良好でない場合は、その後の投与における投与時間は90分以上とすること。
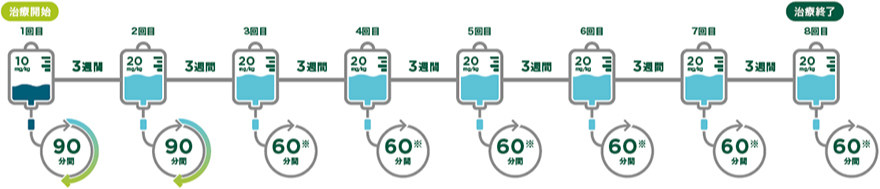
※忍容性が良好でない場合は、その後の注入時間は最短90分以上とすること
投与前の確認事項
聴覚障害が発現する場合があることを患者に説明し、聴覚障害に関連する症状が認められた場合には、医療機関を受診するよう指導してください。
本剤の投与前に聴力検査を行い、また、聴覚障害を評価できる体制が整備されていない医療施設において本剤を投与する場合は、投与前に耳鼻科を専門とする医師の診察を受けた上で、本剤投与開始の適否を慎重に判断してください。
聴覚障害のある患者に対しては、本剤投与の適否を慎重に判断してください。
糖尿病患者、耐糖能異常のある患者に対しては、本剤の治療開始前から血糖値を適切にコントロールしてください。
Infusion reactionが発現する可能性があります。以下の処置等をご検討ください。
→本剤の投与前に抗ヒスタミン薬や解熱薬又は副腎皮質ステロイドを投与してください。
→Infusion reactionが認められた患者に対し、投与速度を遅くしてください。炎症性腸疾患(IBD)患者に対しては、疾患の状態をご確認の上、本剤投与の適否を慎重に判断してください。
妊娠する可能性のある女性には、本剤投与中及び最終投与後5カ月間において避妊する必要性及び適切な避妊法について説明してください。
必要に応じて本剤投与開始前に妊娠検査を実施し、妊娠していないことを確認してください。
投与中の確認事項
聴覚障害(難聴、聴力低下、耳管機能障害、耳管開放、聴覚過敏、耳鳴、鼓膜障害等)があらわれることがあり、重篤かつ不可逆的な事象も報告されています。海外での市販後に重度の聴覚障害が報告されています。
→投与期間中は定期的に聴力検査を行い、患者の状態を十分に観察した上で、投与継続の適切性を慎重に判断してください。また、聴覚障害に関する評価が可能な体制が整っていない医療施設において本剤を投与する場合、投与期間中は定期的に耳鼻科を専門とする医師の診察を受けた上で、本剤投与継続の適否をご判断ください。高血糖又は血中ブドウ糖増加が発現することがあります。また、高血糖により糖尿病性ケトアシドーシス(DKA)や高浸透圧性高血糖状態(HHS)等の重篤な急性合併症を引き起こす可能性があります。
→患者の状態を観察し、適宜薬物療法により血糖値を管理してください。
→高血糖又は糖尿病の既往を有する患者の血糖値が適切にコントロールされるように患者の状態を観察してください。患者をモニタリングし即時型過敏反応又は Infusion reaction を注意深く観察してください。アナフィラキシー反応など異常が認められた場合には直ちに本剤の投与を中止し、適切な処置を行ってください。
IBDが増悪することがあります。
→IBD患者に本剤を投与する際は、疾患の状態をモニタリングしてください。
重要な基本的注意
8. 重要な基本的注意
8.1
本剤投与により聴覚障害(難聴、聴力低下、耳管機能障害、耳管開放、聴覚過敏、耳鳴、鼓膜障害等)があらわれることがあり、重篤かつ不可逆的な事象も報告されている。本剤の投与前及び投与中は定期的に聴力検査を行い、患者の状態を十分に観察した上で、投与継続の適切性を慎重に判断すること。また、本剤投与により聴覚障害が発現する場合があることを患者に説明し、聴覚障害に関連する症状が認められた場合には、医療機関を受診するよう患者に指導すること。
8.2
本剤投与により高血糖又は糖尿病があらわれることがあり、糖尿病性ケトアシドーシス、高浸透圧性高血糖状態に至った症例が報告されている。本剤投与中は、定期的に血糖値、HbA1c等の測定を行うなど、患者の状態を十分に観察すること。
8.3
本剤はタンパク質製剤であり、アナフィラキシー等重度のアレルギー反応が起こる可能性がある。異常が認められた場合には直ちに本剤の投与を中止し、適切な処置を行うこと。





 新規会員登録
新規会員登録 でログイン
でログイン